Los alcanos son compuestos formados exclusivamente por carbono e hidrógeno (hidrocarburos), que solo contienen enlaces simples carbono-carbono.
Tipos de alcanos
Los alcanos se clasifican en lineales, ramificados, cíclicos y policíclicos.
Nomenclatura de alcanos
Los alcanos se nombran terminando en -ano el prefijo que indica el número de carbonos de la molécula (metano, etano, propano...)
Propiedades físicas de los alcanos
Los puntos de fusión y ebullición de alcanos son bajos y aumentan a medida que crece el número de carbonos debido a interacciones entre moléculas por fuerzas de London. Los alcanos lineales tienen puntos de ebullición más elevados que sus isómeros ramificados.Interacción por fuerzas de London
En los alcanos, los puntos de fusión aumentan al aumentar el tamaño molecular, a mayor superficie se produce una mayor atracción debido a las fuerzas de London.
Puntos de ebullición en alcanos
Los puntos de ebullición también aumentan con el peso molecular, cuanto más pesada es una molécula más energía requiere para pasar del estado líquido al gaseoso.
Alcanos lineales y ramificados
Los alcanos ramificados poseen superficies más pequeñas que sus isómeros lineales, por lo que las fuerzas atractivas son menores, dando lugar a puntos de fusión y ebullición mas bajos.
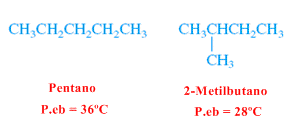
El 2-metilbutano (alcano ramificado) tiene un punto de ebullición menor que el pentano (alcano lineal)
Solubidad en agua
Los alcanos son insolubles en agua dada su casi nula polaridad. Sus densidades se situan entre 0.6 y 0.8 g/ml por lo que flotan en el agua.
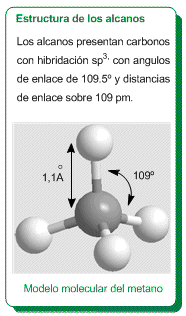
Isómeros conformacionales
Los alcanos no son rígidos debido al giro alrededor del enlace C-C. Se llaman conformaciones a las múltiples formas creadas por estas rotaciones.
Proyección de Newman
La energía de las diferentes conformaciones puede verse en las proyecciones de Newman. Así en el caso del etano la conformación eclipsada es la de mayor energía, debido a las repulsiones entre hidrógenos.
Diagramas de energía potencial
Las diferentes conformaciones de los alcanos se puede representar en un diagrama de energía potencial donde podemos ver que conformación es más estable (mínima energía) y la energía necesaria para pasar de unas conformaciones a otras.
Propiedades Químicas
Los alcanos , son poco reactivos.No reaccionan con oxidantes ni con reductores, ni tampoco con ácidos ni bases. Esta baja reactividad se debe a que sus enlaces son muy estables.
El proceso de la combustión
La combustión es un proceso general de todas las moléculas orgánicas, en la cual los átomos de carbono de la molécula se combinan con el oxígeno convirtiéndose en moléculas de dióxido de carbono (CO2) y los átomos de hidrógeno en agua líquida (H2O). La combustión es una reacción exotérmica, el calor desprendido se llama calor de combustión y en muchos casos puede determinarse con exactitud, lo que permite conocer el contenido energético de las moléculas.
Reaccion de combustión ajustada
Estabilidad de isómeros
Comparando calores de combustión de alcanos isómeros se observa que sus valores no son iguales. Así el 2-metilpropano desprende en su combustión -685.4 kcal/mol, mientras que el butano desprende -687.4 kcal/mol. Estos datos demuestran que el butano tiene un contenido energético superior al 2-metilpropano y por tanto es termodinámicamente menos estable.
Halogenacion
La halogenación del metano es una reacción que transcurre con formación de radicales libres y supone la sustitución de un hidrógeno por halógeno.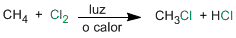
Mecanismo de la reacción
Las halogenaciones radicalarias trancurren en tres etapas denominadas: iniciación, propagación y terminación:
Etapa de iniciación
En el primer paso de la reacción se produce la rotura homolítica del enlace Cl-Cl. Esto se consigue con calor o mediante la absorción de luz.
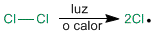
Primera etapa de propagación
Se trata de una etapa ligeramente endotérmica que consiste en la sustracción de un hidrógeno del metano por el radical cloro formado en la etapa anterior, generándose el radical metilo.
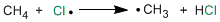
Segunda etapa de propagación
Durante la misma el radical metilo abstrae un átomo de cloro de una de las moléculas iniciales, dando clorometano y un nuevo átomo de cloro. Dicho átomo vuelve a la primera etapa de propagación y se repite todo el proceso.
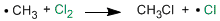
Etapa de terminación
Tiene lugar cuando se agotan los reactivos, entonces los radicales que hay en el medio se unen entre si.
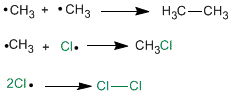
Los Alcanos ramificados
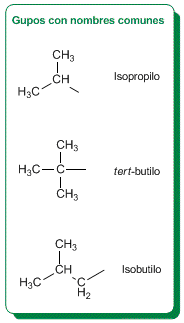
Los alcanos ramificados son hidrocarburos que perdieron un hidrógeno de uno de sus extremos. Estos son alcanos deshidrogenados que actúan como ramificación de una cadena principal. Estos se nombran agregando la terminación il o ilo a los prefijos segun la cantidad de carbono ,(met-il , et-il , prop-il etc.)
Estructura del nombre
El nombre de un alcano está compuesto de dos partes, un prefijo que indica el número de carbonos de la cadena seguido del sufijo -ano que caracteriza este tipo de compuestos, (met-ano, et-ano, prop-ano, but-ano).
Elección de la cadena principal
Encontrar y nombrar la cadena más larga de la molécula. Si la molécula tiene dos o más cadenas de igual longitud, la cadena principal será la que tenga el mayor número de sustituyentes.
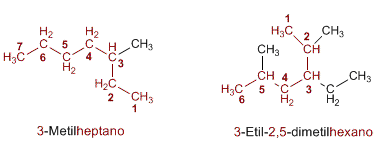
 Numeración de la cadena principal
Numeración de la cadena principal
Numerar los carbonos de la cadena más larga comenzando por el extremo más próximo a un sustituyente. Si hay dos sustituyentes a igual distancia de los extremos, se usa el orden alfabético para decidir cómo numerar.
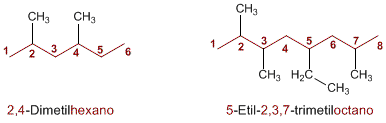
Formación del nombre
 El nombre del alcano se escribe comenzando por el de los sustituyentes en orden alfabético con los respectivos localizadores, y a continuación se añade el nombre de la cadena principal. Si una molécula contiene más de un sustituyente del mismo tipo, su nombre irá precedido de los prefijos di, tri, tetra, ect.
El nombre del alcano se escribe comenzando por el de los sustituyentes en orden alfabético con los respectivos localizadores, y a continuación se añade el nombre de la cadena principal. Si una molécula contiene más de un sustituyente del mismo tipo, su nombre irá precedido de los prefijos di, tri, tetra, ect.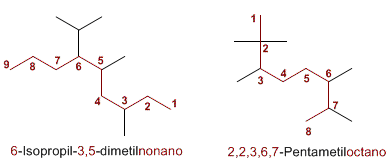
Luego nombramos la cadena principal como un alcano lineal según la cantidad de carbono que tenga la cadena.
Los alcanos se pueden obtener mediante dos maneras: Fuentes naturales y métodos sintéticos.
Fuentes naturales
Muchos de los alcanos se pueden obtener a escala industrial en el proceso de destilación fraccionada del petróleo y del gas natural.
El petróleo es una mezcla compleja de hidrocarburos líquidos y sólidos; el gas natural es principalmente una mezcla de metano (70% – 90%) y etano (13% – 5%).

Métodos sintéticos
Tenemos a:
1Síntesis de Kolbe
Fue ideado por el alemán Herman Kolbe. Consiste en la descomposición electrolítica de un éster de sodio que se halla en solución acuosa. Por acción de la corriente eléctrica, en el ánodo se produce el alcano mas anhidrido carbónico y en el cátodo hidrogeno mas hidróxido de sodio.


donde R – H : alcano
Ejemplo 1: Obtención de etano CH3 – CH3

Ejemplo 2: Obtención del butano CH3 – CH2 – CH2 – CH3

2Síntesis de Grignard
Consiste en dos pasos:
1. Se hace reaccionar un halogenuro de alquilo con magnesio en presencia de éter anhidro (libre de agua), obteniéndose un halogenuro de alquil magnesio denominado “Reactivo de Grignard”.

2. Al reactivo obtenido, se le hace reaccionar con un compuesto apropiado que contenga hidrógeno, obteniéndose el alcano y un compuesto complejo de magnesio.

Ejemplo 1: Obtención de etano

Ejemplo 2: Obtención de propano
3Síntesis de Wurtz
Se hace reaccionar un halogenuro de alquilo con sodio metálico, originándose el alcano y una sal haloidea.

Ejemplo 1: Obtención de etano

4Hidrogenación Catalítica de un Alqueno
Los alquenos se logran hidrogenar, previa ruptura del doble enlace, generándose alcanos de igual número de carbonos que el alqueno inicial, para esto es necesario la presencia de catalizadores que pueden ser: platino, paladio o niquel finamente divididos.

Ejemplo 1: Obtención de butano



